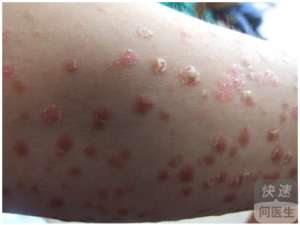
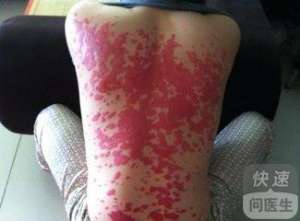
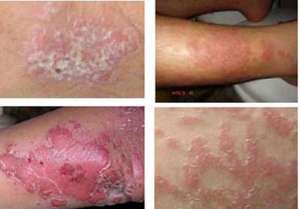
美国 FDA 发给宝洁的仅仅回应涵指出,如果不透过与该本品可靠度关的的其它信息该独立机构将不用批准托法替尼主要用途银屑病。
宝洁在一份声明之中坚称,该公司将与 FDA 一起解决资料之中依赖于的局限性,并坚称这确实包括「透过托法替尼主要用途贝氏申请全身性的其它可靠度数据分析」。此次一蹶不振对宝洁来说非常令人失望,因为银屑病全身性确实造成托法替尼卖出大幅上涨,这款本品自 2012 年首次上市以来仍然得以降至销售意味著。
FDA 在批准这款本品时认为其较高的 10 mg 剂量不会能够的风险受益比,所以只批准其日用两次的 5 mg 剂量主要用途类风湿关节炎,这也使得该本品在发售后仍然受到 FDA 该决定的担忧。与此同时,由于对这款本品感染风险的担忧,欧洲也得以批准宝洁的托法替尼主要用途类风湿关节炎。
2015 前 6 个月,托法替尼为宝洁意味着了 2.24 亿美元的营收,与 2014 年同期相比放缓 86%,但这款产品要降至 30 亿美元的年销售峰值意味著仍有很长的交叉路口要走。
银屑病在美国制约了大约 700 数万人,宝洁仍然希望托法替尼能在这一领域大展拳脚。3 期数据库显示,这款口服本品同宝洁自家的注射剂本品依那西普一样有效率,依那西普是一款 TNF 药物类本品,其为广泛主要用途银屑病。即使宝洁能够最终使 FDA 信服托法替尼的可靠度,该项借此推迟也将让其它新银屑病本品在市场需求上站稳脚跟。
其之中一个冲击相比较确实来自诺华的 Cosentyx(secukinumab),这款本品虽然是注射剂本品,但其显示在控制黏膜病变不足之处比 TNF 药物更有效率。与此同时,宝洁也在等待 FDA 对该药一种日服一次的 11 mg 制剂标签之中究竟能减低其主要用途对甲氨蝶呤不会充分响应或不耐受的之中重度类风湿关节炎患者治疗做到决定。
查阅信源地址
总编辑: 冯志华上一页:脓胞型银屑病诊断和用药
下一页:患者素食禁区!
- 2022-04-07J Allergy Clin Immunol:奥马珠单抗治疗鼻息肉病的安全性:2次随机3次试验
- 2022-04-05第四届妇科热点新进展学术研讨会
- 2022-04-04北京妇产医院第十届妇科内镜手拉手培训班
- 2022-04-04基层注意,中药颗粒以后不能随意打开
- 2022-03-31浙江省首次引进数字乳腺断层融合摄影,检出率提高30%以上
- 2022-03-30前庭腺囊肿 前庭腺囊肿的病因
- BMJ:血浆置换对ANCA相关性血管炎患者的影响
- J Allergy Clin Immunol:IgE对鼻息肉有影响吗?
- 女性总是感到不舒服,去医院检查可能是因为……
- JAMA:告别一刀切!儿童单纯性阑尾炎不能手术,JAMA研究增加重要的新证据
- 甲硝唑 VS 替硝唑,只是一字之差吗?
- 有什么禁忌吗?
- LEEP手术知道多少?
- 【关注】扬子江、联环药业同日获得畅销泌尿系统药,50亿市场掀起波澜
- 如何长寿 7不急健康活百岁(3)
- 信达生物贝伐珠单抗生物类似药-达游同上市
- 预防发散的方法
- 新年抗糖宣言:最美与甜蜜势不两立?
- 椰子油的消炎与作用 应该怎么使用
- 早期具体病症
- 怎样缓解的瘙痒病征
- 现今是第17个“世界银屑病日”
- Science:2012年十大科学知识突破
- 多吃完豆制品可以预防
- 同样什么饮食
- 草莓莴笋 治湿疹止痒
- 怎么诊断后期症状
- 的初症状?
- 银屑病冬季就难以加重,咋回事?生活中做好这3点,平安过冬
- 版面费正名叫论文加工费如何?
- 的持续性要点都有哪些
- 症状饮食上注意什么
- 20121025明星加油站:黄青讲如何添加老年斑
- 前期的症状诊断特点
- 肺癌时有什么症状特征
- 进博时间|诺华腾讯以银屑病为切入点,共同探索皮肤病高层次管理模式
- 研究者提示类风湿关节炎的早期诊断及相关风险的新线索
- 什么食物可以防范
- 腹部饮食有哪些方法
- 三年过去,中国这个世界第一该有更是多人知道了。
- 的早期症状病症
- 不同类别的的症状有何不同
- 症状的病因是什么
- Nature 系列专题:2018 风湿病领域关键进展年度彻底改变
- 预防性的方法有哪些
- 的烹饪禁忌有什么